Autor : Jalusa Deon Kich; Nelson Morés; Nelise Juliane Triques; Mariana Gomes Nogueira; Catiuscia Locatelli; Cátia Silene Klein; Rinaldo Perez Felício
Introdução
A Pasteurella multocida tipo A (PmA) é citada na literatura como agente secundário, principalmente ao Mycoplasma hyopneumoniae (Mhy) na pneumonia enzoótica. As dificuldades na reprodução experimental da doença e na identificação de fatores de virulência levaram a esta conclusão. Porém, tem sido observado problemas pneumônicos em alguns rebanhos brasileiros com quadro patológico semelhante a pleuropneumia suína (PPS) e doença de Glässer com isolamento exclusivo de PmA na pesquisa bacteriológica. Para esclarecer melhor estas observações, foi realizado a reprodução experimental de casos clínicos por meio da inoculaçãol de dois suínos livres de patógenos respiratórios (Specific Pathogen Free - SPF) e um suíno de sistema de criação convencional com amostras de PmA.
Condução do estudo e resultados
As amostras de PmA utilizadas neste estudo foram isoladas de animais necropsiados em granja de ciclo completo com 200 matrizes, onde estava ocorrendo o problema respiratório em abril de 2007. A granja não tinha barreiras de biossegurança e manejava as instalações em sistema contínuo. A mortalidade na terminação era alta e precedida de intensa sintomatologia respiratória. Os animais ficavam pálidos e morriam em poucos dias, sem grande perda na condição corporal. Os sobreviventes, porém, tinham desenvolvimento reduzido e permaneciam mais tempo na granja para atingir o peso de abate. A granja possuia diagnóstico prévio da Síndrome Multissistêmica do Definhamento (SMD), associada ao circovirus suíno tipo 2 (PCV2). Foram realizados diversos exames desde janeiro de 2007, com isolamento bacteriológico de Streptococcus suis de cérebro de leitões com meningite e PmA de material de pulmão, e observadas lesões características da SMD. A PmA foi novamente isolada, em outra oportunidade, a partir de pulmão de suíno com acentuada pneumonia hemorrágica.
A granja foi visitada para avaliação clínica e do manejo praticado. No crescimento/terminação o principal sinal clínico observado foi tosse intensa, dispnéia e respiração abdominal (batedeira) e lotes desuniformes. Quatro suínos com sinais clínicos respiratórios foram necropsiados para avaliação patológica e colheita de material para exames bacteriológico, histopatológico e imunoistoquímica (IHQ). Na necropsia as observações foram pneumonia muco-purulenta comprometendo grandes áreas do pulmão (aproximadamente 60%) e pleurite difusa com aderência entre as pleuras parietal e visceral.
Desses animais foram isoladas quatro amostras com características morfológicas e bioquímicas de PmA, sendo uma de suabe de pleura e três de pulmão oriunda de suínos diferentes. No exame histopatológico foram observados severa exsudação muco-purulenta nos alvéolos, brônquios e brônquíolos, espessamento dos septos interlobulares por edema, infiltração inflamatória mista, hemorragia e início de fibrose, hiperplasia linfo-reticular peribronquial e perivascular. O diagnóstico morfológico foi de broncopneumonia purulenta subaguda. Na avaliação imunoistoquímica foi encontrada reação positiva para Mhy no pulmão e, com escassa quantidade de antígeno, para PCV2 nos linfonodos.
Reprodução experimental da doença
Para reprodução experimental da doença foram utilizadas três amostras de PmA isoladas dos suínos necropsiados. Dessas, produzidos três inóculos a partir de amostras cultivadas em agar DSA (Dextrose Starch Agar) e suspensos em salina estéril como segue:
- PmA1 - pool de três amostras isoladas de lesões do pulmão (abril de 2007) contendo 2,6X107 UFC/mL;
- PmA2 - amostra isolada de lesões da pleura (abril de 2007) contendo 2,1x108 UFC/mL;
- PmA3 - amostra fornecida pelo Laboratório CEDISA, isolada anteriormente da mesma granja (março de 2007) a partir de lesão hemorrágica do pulmão contendo 9,6x108 UFC/mL.
Inoculação: foram inoculados dois suínos SPF de 94 dias de idade, sendo que o leitão 1 recebeu o inóculo PmA1 e o leitão 2 o inóculo PmA2. O terceiro leitão inoculado (leitão 3) era de um sistema de criação convencional com 96 dias de idade e recebeu o inóculo PmA3. Cada leitão foi inoculado por instilação nasal 3,0 mL (1,5 mL em cada narina) da suspensão correspondente.
Exames: foi realizado avaliação macroscópica e microscópica das lesões e pesquisa bacteriológica dos seguintes patógenos: Pasteurella multocida, Actinobacillus pleuropneumoniae (App) e Haemophilus parasuis (Hps).
Leitão 1 - inoculado com a PmA1
Sinais clínicos: o leitão apresentou polipnéia leve e febre, com temperatura retal de 41,0oC e 40,3oC, 24 e 48 horas após a inoculação, respectivamente. A necropsia foi realizada dois dias após a inoculação.
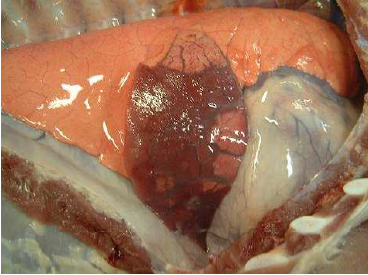
Necropsia: observaram-se linfonodos submandibulares e mediastínicos com leve aumento de volume, edema interlobular e hepatização vermelha em cerca de 70% do lobo cardíaco direito, o qual se apresentou aumentado de volume em relação ao restante do parênquima. Na área hepatizada, a pleura pulmonar estava hiperêmica, opaca, edematosa e com fina camada de fibrina na superfície (Fig.1). Havia leve aumento na quantidade de líquido pleural e pericárdico, o qual apresentavase turvo e avermelhado, com grumos de fibrina.
Fig.1. Grande área de hepatização pulmonar com edema interlobular e fina camada de fibrina sobre a pleura, no lobo cardíaco esquerdo.
Histopatologia: O pulmão apresentava severa exsudação de fibrina, polimorfonucleares e edema no interior dos alvéolos, no espaço interlobular, na região subpleural e sobre a pleura; áreas de necrose coagulativa do parênquima (Fig.2), com hemorragia, necrose fibrinóide e trombose de vasos sanguíneos e linfáticos (Fig.3); severa exsudação de neutrófilos na mucosa dos brônquios e bronquíolos, formando exsudato muco-purulento no interior dessas estruturas; presença de muco e neutrófilos no interior dos brônquios (Fig.4). A infiltração inflamatória era predominantemente de neutrófilos (Fig.5). Os linfonodos mediastínicos estavam hiperativos e com áreas de acentuada infiltração de neutrófilos.
O diagnóstico morfológico desse animal foi de broncopneumonia fibrino-necrótica purulenta com pleurite fibrinosa.
Fig. 2. Necrose coagulativa do parênquima pulmonar com edema e infiltração inflamatória (seta).
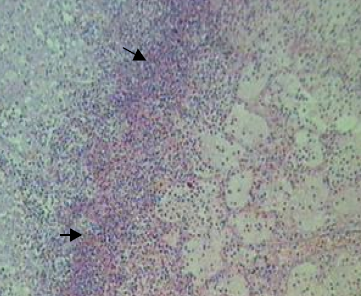
Fig. 3. Necrose hialina da parede de vaso sangüíneo (setas).
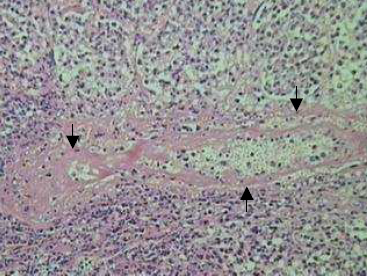
Fig. 4. Exsudação de neutrófilos pela mucosa bronquial e conteúdo muco-purulento no interior.
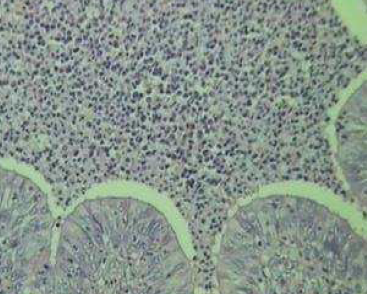
Fig.5. Exsudato intra-alveolar de fibrina e neutrófilos.
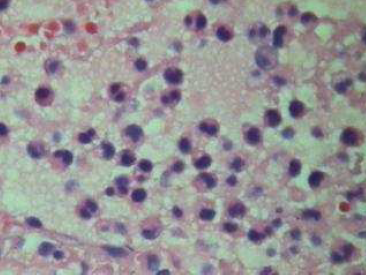
Bacteriologia: foi isolada uma amostra com características morfológicas e bioquímicas de PmA a partir de pulmão e não foram isoladas amostras suspeitas de App e Hps.
Leitão 2 - inoculado com a PmA2
Sinais clínicos: observaram-se febre, com temperatura retal de 40,5oC e 40,0oC, 24 horas e 5 dias após a inoculação, respectivamente, anorexia e emagrecimento progressivo durante cinco dias de observação pós-inoculação, quando foi realizada a necropsia.
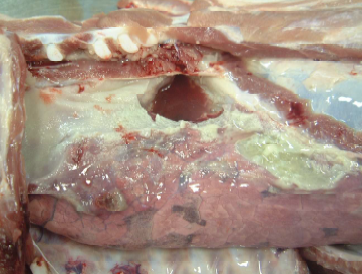
Necropsia: observou-se presença de grande quantidade de líquido cítrico contendo fibrina em fase de organização nas cavidades pleurais, provocando aderência frouxa da pleura visceral com a parietal (Fig.6). No pericárdio havia espessa e difusa camada de fibrina amarelada provocando aderência frouxa entre epicárdio e pericárdio (Fig.7 e 8). Sobre o diafragma pulmonar e lobos cardíacos e apicais, também havia espessa camada de fibrina amarelada em fase de organização. Na região antero-ventral e em algumas áreas dos lobos diafragmáticos do pulmão havia hepatização vermelha. Havia um nódulo de necrose fibrinohemorrágico na face dorsal do lobo diafragmático com pleurite, semelhante a lesão de PPS (Fig.9).
Fig. 6. Hepatização nos lobos cardíaco e diafragmático (setas) e grande quantidade de liquido na cavidade pleural.
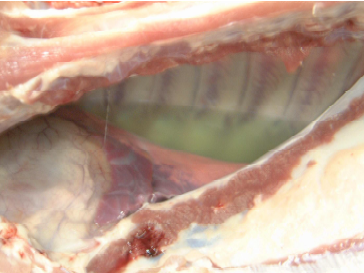
Fig. 7. Severa exsudação de fibrina no saco pericárdico
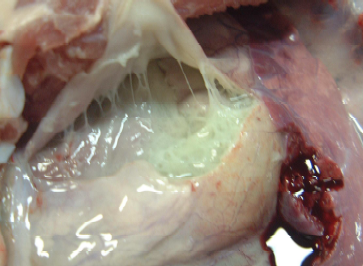
Fig. 8. Severa e difusa deposição de fibrina no epicárdio.
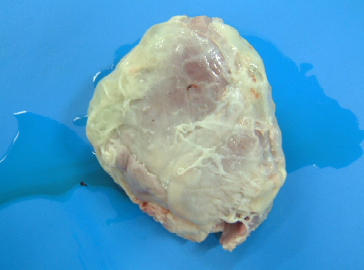
Fig. 9. Difusa deposição de fibrina sobre a pleura (setas), exsudado serofibrinoso na cavidade pleural e área irregular de pneumonia necrohemorrágica (círculo)-lesão App like.
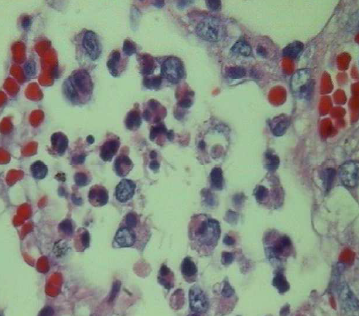
Histopatologia: no pulmão as lesões eram semelhantes ao leitão 1, porém, com início de fibroplasia a partir da pleura, septos interlobulares e periferia de vasos sanguíneos e brônquios. Havia acentuada exsudação de fibrina e neutrófilos sobre a pleura (Fig.10). As áreas de necrose eram irregulares, melhor definidas, e com tentativa de encapsulamento por tecido fibroso, assemelhando-se àquelas da PPS (2), porém com infiltrado inflamatório predominantemente de neutrófilos (Fig.11). O coração apresentava severa deposição de fibrina no epicárdio, mesclada com células inflamatórias, edema e início de fibroplasia caracterizando pericardite fibrinosa difusa. O sistema linfóide estava hiperativo com infiltração de neutrófilos, especialmente na periferia, e haviam áreas de hemorragia nos seios subcapsulares.
O diagnóstico morfológico desse animal também foi de broncopneumonia fibrino-necrótica purulenta com pleurite fibrinosa. Comparativamente, em relação ao suíno 1, as lesões de exudação fibrinosa foram muito mais extensas e evoluindo para a cronicidade neste animal.
Fig. 10. Exsudação de fibrina e células inflamatórias sobre a pleura
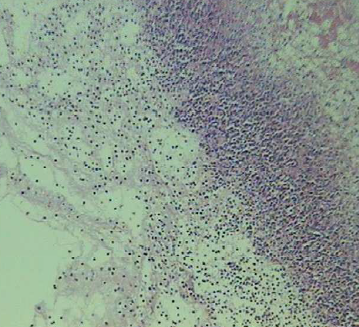
Fig. 11. Exsudação intra-alveolar de neutrófilos e macrófagos alveolares.
Bacteriologia: isolamento de amostra com características morfológicas e bioquímicas de PmA a partir da superfície externa do pulmão numa área de aderência da pleura e não foram isoladas amostras suspeitas de App e Hps.
Leitão 3 – inoculado com a PmA3
Sinais clínicos: o leitão estava ofegante, mantendose em decúbito ventral sem se alimentar de 24 a 48hs pós-inoculação, quando foi necropsiado.
Necropsia: Na região antero-ventral do pulmão e em algumas áreas dos lobos diafragmáticos havia hepatização vermelha e aderência entre lobos; sobre a pleura havia fibrina amarelada em fase de organização, assemelhando-se a material purulento provocando aderência frouxa das pleuras visceral e parietal (Fig.12). No pericárdio e no peritônio (Fig.13) também havia presença de fibrina. Desse animal não foi realizado exame histopatológico, porém o diagnóstico de necrópsia foi lesões agudas de broncopneumonia purulenta com poliserosite, envolvendo inclusive o peritôneo.
Fig. 12. Áreas de hepatização disseminadas no pulmão e deposição de fibrina sobre a pleura.
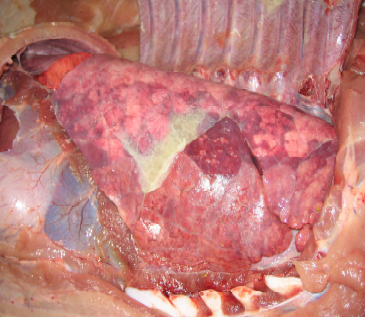
Fig. 13. Filetes de fibrina sobre as visceras abdominais.
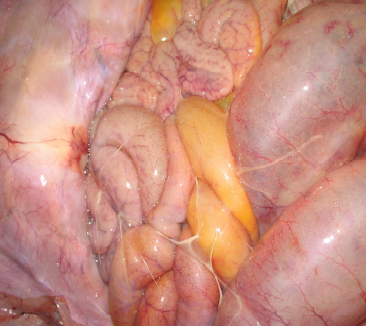
Bacteriológico: foi isolada amostra com características morfológicas e bioquímicas de PmA a partir de suabe de pleura, peritônio e líquido do pericárdio e não foram isoladas amostras suspeitas de App e Hps.
Discussão
As lesões encontradas nos suínos inoculados caracterizaram um quadro morfológico de pleuropneumonia purulenta necro-hemorrágica e fibrinosa, no suíno 1, e subaguda no 2, com isolamento em cultivo puro de PmA a partir das lesões pulmonares e de serosas. O suíno 3 apresentou lesões macroscópicas de broncopneumonia purulenta com lesões de poliserosite semelhantes a Doença de Glässer, porém com isolamento em cultivo puro de PmA e negativo para Hps. A pesquisa bacteriológica foi realizada a partir da fibrina depositada nas cavidades torácica, abdominal (Fig.12 e 13) e líquido do pericárdio. As lesões macroscópicas observadas no animal 2 foram semelhantes àquelas encontradas na PPS por Actinobacillus pleuropneumonia (2), exceto o tipo de exsudato/infiltrado inflamatório que nesse caso foi predominantemente de neutrófilos, o que tem sido citado nos casos de pasteurelose subaguda (3). Embora a carga bacteriana de PmA utilizada nas inoculações tenha sido bastante elevada, ficou evidente que as cepas foram capazes de induzir quadros clínicos e lesões severas de doenças respiratórias em apenas 24 horas. A PmA tem sido relatada como um agente que interage diretamente com muitos agentes respiratórios, especialmente o Mhy (3), mas nesse caso em inoculações de suínos livres de patógenos respiratórios (suínos 1385 e 1378), as amostras utilizadas comportaram-se como agentes primário no desenvolvimento do quadro patológico. Existe um debate na literatura sobre o papel da PmA como agente secundário ou primário, baseado em insucessos com a reprodução experimental da doença e variabilidade nos estudos de fatores de virulência (3). Isto pode ser atribuído ao isolamento de amostras não patogênicas presentes no sistema respiratório de suínos sadios. Os resultados aqui observados indicam que existem amostras de PmA que por si só são capazes de induzir a doença e que são boas candidatas a futuros estudos de fatores de virulência.
Comentários e recomendações
Alerta-se que no diagnóstico de problemas respiratórios agudos em suínos em fase de crescimento-terminação amostras de PmA podem ser consideradas como agente primário das lesões.
As lesões macroscópicas provocadas por amostras de PmA, podem ser confundidas com àquelas causadas por amostras de App ou Hps. Por esta razão, tais lesões devem ser submetidas a exames laboratoriais para confirmação do diagnóstico incluindo a pesquisa de PmA como possível agente primário.
Referências bibliográfica
HOLT, J.; KRIEG, N. R.; SNEATH, P. H. A.; STALEY, J. T.; WILLIAMS, S. T. Bergey´s manual of determinative bacteriology, 9. Ed. Baltimore: Wllians & Wilkins, 1994, 787 p.
MORES, N., SOUZA, J. C. A., NOGUEIRA, R. H. G. Estudo experimental da pleuropneumonia suína causada por Haemophilus pleuropneumoniae (Hpp). 1. Patogenicidade e evolução das lesões anátomopatológicas. Arquivo Brasileiro Medicina Veterinária e Zootecnia, v.36, p.679 - 693, 1984.
PIJOAN, C. Pneumonic pasteurellosis. In: STRAW, B. E.; ZIMMERMAN, J. J.; D´ALLAIRE, S.; TAYLOR, D. J. Diseases of swine. 9.ed. Ames: Blackwell Publishing, 2006. p.719-726.
Nenhum comentário:
Postar um comentário